آموزش اسید و باز حلالیت
آموزش اسید و باز حلالیت
واکنش اسید و باز نوعی واکنش شیمیایی است که بین یک اسید و یک باز اتفاق میافتد. مفاهیم متعددی وجود دارند که تعاریف مختلفی را برای مکانیسمهای واکنش و کاربرد آنها در حل مسایل مربوطه ارائه میدهد.
دوره اسید و باز حلالیت به مسائل مختلف در این حوزه میپردازد. امید است کاربران پزشک آموز پس از گذراندن این دوره، بتوانند بخش اعظمی از نیازهای خود را برآورد نمایند.
سرفصل و رئوس مطالب:
- اسید و باز
- حلالیت
- …
این دوره برای چه کسانی مفید است:
- دانشجویان پزشکی
- دانشجویان علوم پایه
برای دیدن ویدیو های بیشتر میتوانید به صفحه آموزه علمی ما سر بزنید.
شما شاید این را هم دوست داشته باشید
29,000 تومان
آموزش اسید و باز حلالیت دکتر محمدعلی ابراهیم زاده
آموزش اسید و باز حلالیت پرفسور محمد علی ابراهیم زاده
واکنش اسید و باز نوعی واکنش شیمیایی است که بین یک اسید و یک باز اتفاق میافتد. مفاهیم متعددی وجود دارند که تعاریف مختلفی را برای مکانیسمهای واکنش و کاربرد آنها در حل مسایل مربوطه ارائه میدهد.
آموزش اسید و باز حلالیت
شامل بخش های مفاهیم محلول ها: انحلال، الکترولیت، درجه و درصد تفکیک،
تفکیک یونی اسیدها بازها، تعاریف اسید و باز، اسید وباز قوی و ضعیف،
هیدرولیز، اثریون مشترک، تامپون
غلظت ها:درصد، گرم بر لیتر، مولاریته، مولالیته ،نرمالیته، محلول سازی،
سنجش های حجمی و پی اچ
و حاصلضرب حلالیت Ksp می باشد.
این برنامه علاوه بر نکات بخش های فوق، ۱۵۰ تست (مفاهیم و غلظت ها هر
کدام ۵۵ تست و حاصلضرب حلالیت ۴۰ تست) که از تست های کنکور سال های گذشته انتخاب شده تا کاربران با استفاده
از آنها مهارت خود را در این بخش از دانش شیمی گسترش دهند.
لطفآ با ایده ها و انتقادات همچنین گزارش اشکالات احتمالی ما را در
شامل بخش های مفاهیم محلول ها: انحلال، الکترولیت، درجه و درصد تفکیک،
تفکیک یونی اسیدها بازها، تعاریف اسید و باز، اسید وباز قوی و ضعیف،
هیدرولیز، اثریون مشترک، تامپون
غلظت ها:درصد، گرم بر لیتر، مولاریته، مولالیته ،نرمالیته، محلول سازی،
سنجش های حجمی و پی اچ
و حاصلضرب حلالیت Ksp می باشد.
این برنامه علاوه بر نکات بخش های فوق، ۱۵۰ تست (مفاهیم و غلظت ها هر
کدام ۵۵ تست و حاصلضرب حلالیت ۴۰ تست) که از تست های کنکور سال های گذشته انتخاب شده تا کاربران با استفاده
از آنها مهارت خود را در این بخش از دانش شیمی گسترش دهند.
فرمول شیمیایی : CH2O2
این ماده با نام جوهر مورچه هم شناخته می شود. زیرا مورچه ها نیز این ماده را از خود منتشر می نمایند. اسید فرمیک در نساجی و تهیه ی خوراک دام کاربرد عمده ای دارد.
واکنش خنثی شدن در اسید ها چگونه اتفاق می افتد؟
هنگامی که یون H+ با یون oH- مواجه می شود این یون ها می توانند منجر به تولید آب گردند.
از آنجا که واکنش های خنثی سازی باعث از بین رفتن و به دست آوردن یون های هیدروژن می شود ، این فرآیند را “انتقال پروتون” می نامند.
خنثی سازی در اسید ها با کمک باز ها صورت می گیرد و یون های OH- موجود در باز ها با H+ موجود در اسید وارد واکنش می شود و تولید آب می کند. محصول دیگر حاصل این واکنش نمک است.
لطفآ با ایده ها و انتقادات همچنین گزارش اشکالات احتمالی ما را در
بهبود این برنامه یاری نمایید.
بهبود این برنامه یاری نمایید.
دوره اسید و باز حلالیت به مسائل مختلف در این حوزه میپردازد. امید است کاربران پزشک آموز پس از گذراندن این دوره، بتوانند بخش اعظمی از نیازهای خود را برآورد نمایند.
دانلود فیلم آموزشی اسید و باز حلالیت
دانلود ویدیو آموزشی اسید و باز حلالیت
دانلود ویدئو آموزشی اسید و باز حلالیت
سرفصل و رئوس مطالب:
- اسید و باز
- حلالیت
- …
این دوره برای چه کسانی مفید است:
- دانشجویان پزشکی
- دانشجویان علوم پایه
دوره اسید و باز پزشک آموز
برای دیدن ویدیو های بیشتر میتوانید به صفحه آموزه علمی ما سر بزنید.
آموزش اسید و باز حلالیت
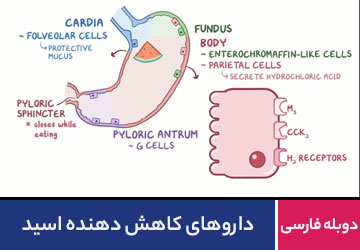
محیطی که در دمای ۲۵ درجه سانتیگراد، pH آن بیشتر از ۷ باشد محیط قلیایی یا بازی نامیده میشود. قلیا عبارت است از ترکیبهای فلزهای قلیایی یا قلیایی خاکی که دارای گروه –OH هستند و محلول آنها میتواند چربیها را در خود حل کند.
باز ها گروه دیگری از مواد شیمیایی هستند که دارای ویژگی های زیر می باشند:
- تلخ مزه هستند.
- در تماس با پوست بدن آن را لیز یا صابون مانند می کنند.
- محلول آن ها رسانای جریان الکتریسیته است.
- با اسید ها واکنش داده و نمک و آب تولید می کنند.
از باز های معروف می توان گرد لوله بازکنی فاضلاب (چنته)، وایتکس، مایع سفید کننده، آب پوست پرتقال، مایع آمونیاک، و جوش شیرین نام برد.
محیطی که در دمای ۲۵ درجه سانتیگراد، pH آن بیشتر از ۷ باشد محیط قلیایی یا بازی نامیده میشود. قلیا عبارت است از ترکیبهای فلزهای قلیایی یا قلیایی خاکی که دارای گروه –OH هستند و محلول آنها میتواند چربیها را در خود حل کند.
باز ها گروه دیگری از مواد شیمیایی هستند که دارای ویژگی های آموزش اسید و باز حلالیت زیر می باشند:آموزش اسید و باز حلالیت
حالا ببینیم چطور میتوان جدول رنگی کلم قرمز را تنظیم کرد.
محلولهایی با تمام درجات PH درست کنید. با دروبین دیجیتال از تمام کاغذهای کلمی که در محلولها قرار دادید بعد ازاینکه آنها را خارج کردید و خشک شدند، عکس بگیرید. بوسیلهی نرم افزار Edit عکس مثل فتوشاپ تعیین رنگهایی که بدست آوردید بسیار ساده میشود. برای ادامهی این آزمایش لازم است که یک PHمتر تهیه کنید.
مواد و وسایلی که برای تنظیم جدول رنگی کاغذ کلم قرمز مورد نیاز است
- تلخ مزه هستند.
- در تماس با پوست بدن آن را لیز یا صابون مانند می کنند.
- محلول آن ها رسانای جریان الکتریسیته است.
- با اسید ها واکنش داده و نمک و آب تولید می کنند.
از باز های معروف می توان گرد لوله بازکنی فاضلاب (چنته)، وایتکس، مایع سفید کننده، آب پوست آموزش اسید و باز حلالیت، مایع آمونیاک، و جوش شیرین نام برد.
محیطی که در دمای ۲۵ درجه سانتیگراد، pH آن بیشتر از ۷ باشد محیط قلیایی یا بازی نامیده میشود. قلیا عبارت است از ترکیبهای فلزهای قلیایی یا قلیایی خاکی که دارای گروه –OH هستند و محلول آنها میتواند چربیها را در خود حل کند.
باز ها گروه دیگری از مواد شیمیایی هستند که دارای ویژگی های زیر می باشند:
د به مورد متفاوت است و به عهدهی آموزش اسید و باز حلالیت یا اولیاست که متناسب با سطح درسی دانشآموز خود آزمایشهای مناسب وی را انتخاب کنند.
امیدواریم شما معلمان عزیز با راهنماییهای خود ما را در بهبود این مطالب یاری نمایید.واکنش شیمیایی
اولین آزمایش و مشاهده برای معرفی مفهوم واکنش شیمیایی ارائه میشود که میتوان آن را در مقطع ابتدایی انجام داد. این آزمایش کمک میکند بچهها بفهمند چگونه اسید و باز بر هم اثر میکنند.
درنصف لیوان آب چند قاشق چایخوری جوششیرین بریزید و آن را خوب هم بزنید تا محلول یکنواختی حاصل شود. در همان لیوان یک قاشق غذاخوری سرکه بریزید. همان طور که مشاهده میکنید مقدار فراوانی کف ایجاد میشود(شکل ۲). چه اتفاقی اقتاده است؟
یک واکنش شیمیایی بین سرکه (یک اسید) و جوششیرین (یک باز) رخ داده است. این آموزش اسید و باز حلالیت ماده با هم واکنش داده و تولید نمک، آب و دی اکسید کربن میکنند. این گاز حبابهای کوچکی که میبینید را ایجاد می کند. درکل، مواد اسیدی و بازی با هم واکنش میدهند و نمک و سایر مواد مثل آب و دی اکسید کربن تولید میشود. اگر میخواهید واکنش با سرعت بیشتری انجام آموزش اسید و باز حلالیت شود از آب گرم (نه جوش) استفاده کنید.
نمکی که در این واکنش تولید می شود استات سدیم است :
اسیدها، بازها و PH
در جهان میلیونها مادهی شیمیایی وجود دارد. بعضی از آنها دارای خاصیت اسیدی و بعضی دیگر دارای خاصیت بازی هستند. اسیدها آموزش اسید و باز حلالیت موادی هستند که در ترکیب با آب یون هیدروژن (+H) آزاد می کنند. بازها موادی هستند که در ترکیب با آب یون هیدروکسید (-OH) آزاد می کنند (آزاد شدن یون دراین گونه واکنش ها تفکیک نامیده میشود). یون هیدروکسید آزاد با یون هیدروژن مولکول آب تولید می کند: H+ + OH- = H2O .
در این حالت بازها تراکم یون هیدروژن را در محلول کاهش می دهند. محلولی که غنی از یونهای هیدروژن است را اسیدی و محلولی که مقدار کمی یون هیدروژن دارد را بازی می نامند. بعضی از اسیدها بصورت جزئی تفکیک میشوند و به آنها اسید ضعیف می گویند؛ بعضی دیگر تفکیک کامل دارند و اسید قوی نامیده میشوند. بازها هم به همین ترتیب میتوانند ضعیف یا قوی باشند.
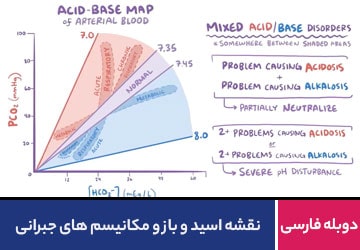
اسیدها و بازهای رقیق که کمتر اشباع هستند فعالیت کمتری در واکنش ها دارند. میزان اسیدی و بازی بودن مواد بوسیلهی واحدهای PH اندازه گیری میشود. شاخص مورد استفاده محدودهای بین ۰ تا ۱۴ دارد. موادی که PH پائینتر از ۷ دارند اسید، آنهایی که PH مساوی ۷ دارند خنثی و آنهایی که PH بالاتر از ۷ دارند را باز مینامند. موادی که PH خیلی پایین دارند اسید قوی و آنهایی که PH خیلی بالا دارند باز قوی هستند. اسیدها و بازهای غلیظ بسیار خورنده و خطرناک هستند.
(مطالب ذیل مخصوص دانش آموزان دورهی دبیرستان است.)
PH سنجشی برای میزان تراکم یا غلظت یون هیدروژن در محلول است. از آنجا که تعداد رقمهای این کمیت بسیار زیاد خواهد شد، آن را با لگاریتم در مبنای ده نشان میدهند و چون این تراکم همواره از ۱ کوچکتر است لگاریتم همیشه علامت منفی میگیرد و برای جلوگیری از نوشتن علامت منفی، قرار داد شده که همواره آن را با علامت مثبت بنویسند (یک علامت منفی به آن اضافه شده). بنابراین PH ،لگاریتم غلظت یون هیدروژن است و آن را اینگونه نشان می دهند: [+PH=-log[H
بنابراین هرگاه PH عدد کمتری داشته باشد، غلظت یون هیدروژن بیشتر است.
آب مقطر PH =7 دارد. پس چطور ممکن است که آب مقطر یون هیدروزن آزاد داشته باشد؟ این پدیده به علت تفکیک جزئی برخی از مولکولهای آب آموزش اسید و باز حلالیت در اثر آشفتگی گرمایی است (H2O- ↔ H+ + OH). این یونها بلافاصله به هم میپیوندند و مولکولهای دیگر تفکیک میشوند. به این ترتیب یک تعادل دائمی در غلظت مولکولهای تفکیک شده وجود دارد.
اندازهگیری PH
موادی وجود دارد که قابلیت تغییر رنگ دربرخورد با محیطهای اسیدی و بازی دارند. این مواد اصطلاحا «PH indicator» ، یا معرف PH نامیده می شوند. برای مثال «فنول فتالئین» و «بروموتیمول بلو» استفاده میشود. معمولا برای اندازهگیری PH از کاغذهای مخصوص آغشته به معرف استفاده می کنند. این کاغذها وقتی که در محلولهای اسیدی یا بازی فرو برده میشوند، بلافاصله دچار تغییر رنگ میشوند. در این مورد کاغذ لیتموس (یا ترنسل) برای همه شناخته شده است. (شکل ۳). امروزه اندازهگیری PH بوسیلهی ابزارهای الکترونیکی مثل «PH متر» امکانپذیر شده است (شکل ۴).
کاغذ لیتموس
لیتموس مادهای است که از گلسنگهای خاصی بدست میآید.لیتموس قابلیت این را دارد که در مقابل مواد اسیدی به رنگ قرمز و در مقابل مواد بازی به رنگ آبی در آید. در بستهبندی کاغذ لیتموس یک مقیاس رنگی وجود دارد که رنگ کاغذ در PH مورد نظر را نشان میدهد(شکل۳).
استفاده از کاغذ لیتموس
استفاده از کاغذ لیتموس بسیار ساده است. ابتدا گوشهی انتهای کاغذ را در مایعی که میخواهید آزمایش کنید فرو ببرید و به سرعت خارج کنید. PH مایع با مقایسه رنگ کاغذ با جدول رنگی یا مقیاس در اختیارتان مشخص میشود.
PHمتر وسیلهای الکترونیکی است که بخش حبابی شکل آن حساس به غلظت یون هیدروژن موجود در محلول مورد آزمایش است. آموزش اسید و باز حلالیت که بوسیلهی حباب ایجاد میشود تقویت شده و به نمایشگر فرستاده میشود. قبل از استفاده از PHمتر باید آن را ست (استاندارد) کرد. برای این کار الکترود آن را در محلول بافربا PH معلوم قرار میدهیم. اگر PH دقیق رانشان ندهد دستگاه را روی PH اسمی بافر، به کمک دکمههای روی نمایشگر تنظیم میکنیم (شکل ۴).
در آزمایشی که شرح دادیم PH محلول اشباع جوش شیرین، سرکه و محلول حاصل از ترکیب این دو را به کمک کاغذ لیتموس اندازه بگیرید. اگر PHمتر در اختیار دارید آزمایش را با آن تکرار کنید.
عصارهی کلم قرمز یک معرف!
همانطور که دیدیم آموزش اسید و باز حلالیت و باز آموزش اسید و باز حلالیتتغییر رنگ مواد مشخصی را دارند. این مسئله در مورد عصارهی کلم قرمز هم صادق است. این مایع دارای رنگ آبی مایل به بنفش است، ولی در مقابل مواد اسیدی به رنگ قرمز و در مقابل مواد بازی به رنگ سبز و حتی زرد در میآید. بگذارید ببینیم چطور میتوان از عصارهی کلم برای اندازه گیری PH مواد مختلف استفاده کرد.
کلم قرمز را میتوانید در فصل زمستان و بهار به راحتی پیدا کنید. آن را به قطعات کوچک برش بزنید (شکل ۶). و در ظرفی بریزید. مقداری آب آموزش اسید و باز حلالیت بر روی آن بریزید تا اندازهای که سطح کلمها را بپوشاند. حدود نیم ساعت آن را بجوشانید و بگذارید سرد شود. عصاره کلم را در ظرف کوچکتری بریزید(شکل۸). کلمها هم قابل مصرف هستند و میتوانید در غذا مصرف کنید.
مقداری کاغذ صافی سفید (porous) ببرید و آنها را در عصاره غوطهور کنید تا کاملا عصاره به خورد کاغذ برود(شکل ۱۰). بعد از نیم ساعت کاغذها را خارج کنید و کنار بگذارید تا خشک شود(شکل ۱۱). بعد آنها را بصورت نوارهای آموزش اسید و باز حلالیت ببرید. میتوانید آنها را ماهها نگه دارید. اگر میخواهید عصاره کلم را نگه دارید آن را در یخچال بگذارید چون بعد از مدتی فاسد خواهد شد.
از عصارهی کلم قرمز به عنوان معرف در فاز مایع استفاده کنید.
- تلخ مزه هستند.
-
مواد و وسایلی که برای تنظیم جدول رنگی کاغذ کلم قرمز مورد نیاز است
- تلخ مزه هستند.
- در تماس با پوست بدن آن را لیز یا صابون مانند می کنند.
- محلول آن ها رسانای جریان الکتریسیته است.
- با اسید ها واکنش داده و نمک و آب تولید می کنند.
از باز های معروف می توان گرد لوله بازکنی فاضلاب (چنته)، وایتکس، مایع سفید آموزش اسید و باز حلالیت آموزش اسید و باز حلالیت ، آب پوست پرتقال، مایع آمونیاک، و جوش شیرین نام برد.
محیطی که در دمای ۲۵ درجه سانتیگراد، pH آن بیشتر از ۷ باشد محیط قلیایی یا آموزش اسید و باز حلالیت نامیده میشود. قلیا عبارت ا آموزش اسید و باز حلالیت ست از ترکیبهای فلزهای قلیایی یا قلیایی خاکی که دارای گروه –OH هستند و محلول آنها میتواند چربیها را در خود حل کند.
باز ها گروه دیگری از مواد شیمیایی هستند که دارای ویژگی آموزش اسید و باز حلالیت زیر می باشند:
د به مورد متفاوت است و به عهدهی معلم یا اولیاست که متناسب با سطح درسی دانشآموز خود آزمایشهای مناسب وی را انتخاب کنند.
امیدواریم شما معلمان عزیز با راهنماییهای خود ما را در بهبود این مطالب یاری نمایید.واکنش شیمیایی آموزش اسید و باز حلالیت
اولین آزمایش و مشاهده برای معرفی مفهوم واکنش شیمیایی ارائه میشود که میتوان آن را در مقطع ابتدایی انجام داد. این آزمایش کمک میکند بچهها بفهمند چگونه اسید و باز بر هم اثر میکنند.
درنصف لیوان آب چند قاشق چایخوری جوششیرین بریزید و آن را خوب هم بزنید تا محلول یکنواختی حاصل شود. در همان لیوان یک قاشق غذاخوری سرکه بریزید. همان طور که مشاهده میکنید مقدار فراوانی کف ایجاد میشود(شکل ۲). چه اتفاقی اقتاده است؟
یک واکنش شیمیایی بین سرکه (یک اسید) و جوششیرین (یک باز) رخ آموزش اسید و باز حلالیتاست. این دو ماده با هم واکنش داده و تولید نمک، آب و دی اکسید کربن میکنند. این گاز حبابهای کوچکی که میبینید را ایجاد می کند. درکل، مواد اسیدی و بازی با هم واکنش میدهند و نمک و سایر مواد مثل آب و دی اکسید کربن تولید میشود. اگر میخواهید واکنش با سرعت بیشتری انجام شود از آب گرم (نه جوش) استفاده کنید.
نمکی که در این واکنش تولید می شود استات سدیم است :آموزش اسید و باز حلالیت
اسیدها، بازها و PH
در جهان میلیونها مادهی شیمیایی وجود دارد. بعضی از آنها دارای خاصیت اسیدی و آموزش اسید و باز حلالیت دیگر دارای خاصیت بازی هستند. اسیدها موادی هستند که در ترکیب با آب یون هیدروژن (+H) آزاد می کنند. بازها موادی هستند که در ترکیب با آب یون هیدروکسید (-OH) آزاد می کنند (آزاد شدن یون دراین گونه واکنش ها تفکیک نامیده میشود). یون هیدروکسید آزاد با یون هیدروژن مولکول آب تولید می کند: H+ + OH- = H2O .
در این حالت بازها تراکم یون هیدروژن را در محلول کاهش می دهند. محلولی که غنی از یونهای هیدروژن است را اسیدی و محلولی که مقدار کمی یون هیدروژن دارد را بازی می نامند. بعضی از اسیدها بصورت جزئی تفکیک میشوند و به آنها اسید ضعیف می گویند؛ بعضی دیگر تفکیک کامل دارند و اسید قوی نامیده میشوند. بازها هم به همین ترتیب میتوانند ضعیف یا قوی باشند.
اسیدها و بازهای رقیق که کمتر اشباع هستند فعالیت کمتری در واکنش ها دارند. میزان اسیدی و بازی بودن مواد بوسیلهی واحدهای PH اندازه گیری میشود. شاخص مورد استفاده محدودهای بین ۰ تا ۱۴ دارد. موادی که PH پائینتر از ۷ دارند اسید، آنهایی که PH مساوی ۷ دارند خنثی و آنهایی که PH بالاتر از ۷ دارند را باز مینامند. موادی که PH خیلی پایین دارند اسید قوی و آنهایی که PH خیلی بالا دارند باز قوی هستند. اسیدها و بازهای غلیظ بسیار خورنده و خطرناک هستند.
(مطالب ذیل مخصوص دانش آموزان دورهی دبیرستان است.)آموزش اسید و باز حلالیت
PH سنجشی برای میزان تراکم یا غلظت یون هیدروژن در محلول است. از آنجا که تعداد رقمهای این کمیت بسیار زیاد خواهد شد، آن را با لگاریتم در مبنای ده نشان میدهند و چون این تراکم همواره از ۱ کوچکتر است لگاریتم همیشه علامت منفی میگیرد و برای جلوگیری از نوشتن علامت منفی، قرار داد شده که همواره آن را با علامت مثبت بنویسند (یک علامت منفی به آن اضافه شده). بنابراین PH ،لگاریتم غلظت یون هیدروژن است و آن را اینگونه نشان می دهند: [+PH=-log[H
بنابراین هرگاه PH عدد کمتری داشته باشد، غلظت یون هیدروژن بیشتر است.
آب مقطر PH =7 دارد. پس چطور ممکن است که آب مقطر یون هیدروزن آزاد داشته باشد؟ این پدیده به علت تفکیک جزئی برخی از مولکولهای آب در اثر آشفتگی گرمایی است (H2O- ↔ H+ + OH). این یونها بلافاصله به هم میپیوندند و مولکولهای دیگر تفکیک میشوند. به این ترتیب یک تعادل دائمی در غلظت مولکولهای تفکیک شده وجود دارد.
اندازهگیری PH
موادی وجود دارد که قابلیت تغییر رنگ دربرخورد با محیطهای اسیدی و بازی دارند. این مواد اصطلاحا «PH آموزش اسید و باز حلالیت » ، یا معرف PH نامیده می شوند. برای مثال «فنول فتالئین» و «بروموتیمول بلو» استفاده میشود. معمولا برای اندازهگیری PH از کاغذهای مخصوص آغشته به معرف استفاده می کنند. این کاغذها وقتی که در محلولهای اسیدی یا بازی فرو برده میشوند، بلافاصله دچار تغییر رنگ میشوند. در این مورد کاغذ لیتموس (یا ترنسل) برای همه شناخته شده است. (شکل ۳). امروزه اندازهگیری PH بوسیلهی ابزارهای الکترونیکی مثل «PH متر» امکانپذیر شده است (شکل ۴).آموزش اسید و باز حلالیت
کاغذ لیتموس آموزش اسید و باز حلالیت
ید و باز حلالیت
| نوع فایل | ویدئو |
|---|
- دسترسی به فایل محصول به صورت مادامالعمر
- تضمین کیفیت آموزش ها
- فعالسازی آنی لینک دانلود، پس از ثبت سفارش
- پزشک آموز هیچ مسئولیتی در قبال محتوای به اشتراک گذاشته شده نخواهد داشت.

پرفسور محمدعلی ابراهیم زاده
29,000 تومان
















 [/accordion-item][/accordion]
[/accordion-item][/accordion] [/accordion-item][/accordion]
[/accordion-item][/accordion]
هیچ دیدگاهی برای این محصول نوشته نشده است.